« Au suivant ! » : La cytométrie en flux pour l’analyse de ploïdie chez les plantes
Dans des précédents billets, j’ai évoqué deux stratégies d’amélioration des plantes très utilisées : l’hybridation inter-spécifique et la fixation du matériel génétique par haplométhodes .Dans les deux cas, la question de la fertilité des plantes obtenues se pose très vite.Celle-ci est directement liée au niveau de ploïdie des plantes générées.
Seuls les nombres pairs de jeux de chromosomes équivalents permettent cette fertilité, et dans la plupart des espèces, le niveau diploïde domine. Mais comment déterminer ce niveau de ploïdie ?
Attendre de pouvoir observer la fertilité d’une plante issue d’hybridation interspécifique ou d’haploïdisation est long et couteux. Il faut élever les plantes puis les observer avec attention, voire tenter de les autoféconder avant de constater, dans le pire des cas, leur stérilité.
Plusieurs approches ont été développées depuis longtemps pour tenter de prédire cette stérilité lorsqu’elle est due à des problèmes de quantités de chromosomes ou de niveau de ploïdie. Les méthodes classiques reposent sur l’observation du phénotype des plantes (lorsqu’on maîtrise suffisamment bien l’espèce !) et sur la microscopie. En microscopie, il est possible de compter les chromosomes dans des cellules méristématiques de plantes en cours de mitose. Une méthode plus simple à mettre en œuvre consiste à compter le nombre de chloroplastes dans les cellules de garde de stomates ou à mesurer la longueur de ces cellules. Dans les deux cas, le travail est long et minutieux !
Le développement d’équipements d’analyse de cellules par cytométrie en flux pour quantifier l’ADN a ouvert des perspectives de tri précoce de plantes très efficace et précis. Ces équipements permettent de combiner le marquage spécifique de l’ADN par des fluorochromes à une mesure individuelle précise de la quantité de fluorescence émise par les cellules d’un tissu après ce marquage et une excitation par un faisceau lumineux de longueur d’onde adéquate. La mesure de la quantité de fluorescence émise par des milliers de cellules permet alors au cytomètre de bâtir un profil qui, en comparaison d’un profil témoin diploïde permettra de conclure sur la quantité d’ADN de l’individu testé, et donc son niveau de ploïdie .
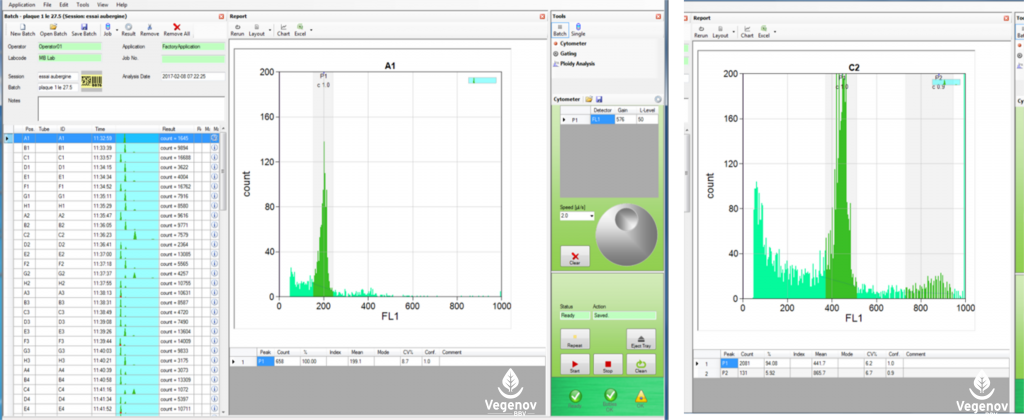
L’interface logicielle du cytomètre en flux permet de disposer des résultats de comptage des cellules en fonction de l’intensité de leur fluorescence sous forme d’un histogramme pour chaque échantillon. L’histogramme de gauche représente le résultat obtenu pour une plante diploïde, celui de droite est donc tétraploïde. A l’extrême gauche figure la feuille de données résultant d’analyses avec le passeur d’échantillon du CyFlow Space de Partec.
Concrètement, le technicien doit prélever un échantillon de feuille jeune mais bien étalée sur la plante à tester. Cet échantillon est ensuite haché pour libérer les cellules, puis coloré avec fluorochrome contenu dans un tampon adapté à l’espèce végétale, et enfin filtré avant passage au cytomètre en flux. La détermination du niveau de ploïdie se fait alors par observation du graphe produit et interprétation. Cette opération, si elle reste très manuelle, présente l’avantage d’être beaucoup plus rapide que les précédentes, mais également d’être quantitative et précise. A chaque nouvelle espèce travaillée par le laboratoire, une mise au point peut être nécessaire afin d’obtenir une qualité d’analyse suffisante. La stabilité et la finesse des pics observés dépendent du mode de prélèvement de l’échantillon, du tampon et de la méthode d’extraction des cellules, mais aussi des tissus prélevés !
Aujourd’hui, les cytomètres de flux ont encore évolué. Les lampes à mercure utilisées pour la provoquer la fluorescence sous UV ont été remplacées par des diodes ou des lasers, moins dangereux, et des passeurs d’échantillons ont été développés. Le prélèvement reste une opération incontournable, mais le travail technique est beaucoup moins répétitif, les cadences sont bien supérieures ! La taille réduite des échantillons dans le cas de l’utilisation du passeur permet d’évaluer la ploïdie de plantes très petites, voire in vitro.

Cytomètre en flux (au centre) équipé d’un système passeur d’échantillons en plaques 96 puits (à droite) et de son interface de traitement des résultats (à gauche).
Ces cytomètres en flux de paillasse sont maintenant très accessibles pour les laboratoires de culture in vitro et ont des applications diverses. Cependant, les usages offerts par des cytomètres en flux plus sophistiqués sont encore plus nombreux. En effet, ils peuvent mesurer plusieurs paramètres cellulaires en même temps grâce à des jeux de lasers et de filtres différents, quantifier avec précision la quantité d’ADN, jusqu’au fragment de chromosome prêt, effectuer du tri cellulaire à l’échelle d’un échantillon etc.
Les applications en routine ou en recherche sont très nombreuses. Mais il faut savoir que, même ponctuellement, la quantification de l’ADN par cytométrie en flux peut vous prémunir de mauvaises surprises ! En permettant par exemple de vérifier que le niveau de ploïdie d’une plante hybride de départ ou d’une nouvelle accession est bien celui qu’on attend…
Crédits photo :
Cars in traffic jam entering a funnel- © CurvaBezier Fotolia Profils en cytométrie - © Vegenov Cytomètre - © MMédia





