Mon pollen est-il vivant ?

Mesurer la qualité du pollen est essentiel dans les processus de création variétale et de production de semences. Cependant, déterminer la viabilité ou le stade de développement de grains de pollen n’est pas aisé. Jusqu’à présent, les méthodes utilisées (comptage en microscopie avec des colorations) sont longues et fastidieuses. Développée par Amphasys, une nouvelle technique permettant des analyses automatisées et basée sur l’analyse de cellules isolées par impédance en cytométrie de flux a été développée. Faisons le point sur cette avancée !
Pourquoi mesurer la qualité du pollen ?
La qualité du pollen est un des facteurs clés des processus de sélection et production de semences.
Le stockage dans le temps des grains de pollen matures permet notamment la réalisation d’hybridations entre des génotypes ne fleurissant pas au même moment. En production de semences, la qualité du pollen et l’impact des conditions environnementales à la floraison sont des paramètres primordiaux. La stérilité mâle est recherchée pour simplifier la réalisation des semences hybrides F1.
Au laboratoire, le recours à l’androgenèse nécessite de prélever le pollen immature (microspores) à certains stades précis pour produire des lignées d’haploïdes doublés.
L’estimation des paramètres de qualité du pollen comme le stade de développement, la viabilité et la capacité de germination est donc cruciale pour le succès de tous ces processus.
Des méthodes fastidieuses et pas toujours fiables
Le pollen est un type de cellule au développement très spécifique dans la plante. Au cours de sa maturation, il va changer de taille ; la composition de son cytoplasme va évoluer ; il va subir des divisions cellulaires. Une paroi cellulaire très résistante qui va le protéger de la déshydratation et des agressions du milieu externe va se développer. Chaque espèce de plante a un pollen unique, et les méthodes d’analyse étaient jusqu’à présent différentes à chaque fois.
Diverses méthodes sont utilisées couramment pour déterminer la qualité du pollen :
- Comptage en microscopie avec des colorations pour déterminer le stade de développement ou la viabilité,
- Germination in vitro ou in situ du pollen.
Ces méthodes présentent plusieurs contraintes. Les colorations de viabilité du pollen diffèrent selon les espèces (Jahier et al., 1992) et sont parfois difficiles à interpréter.
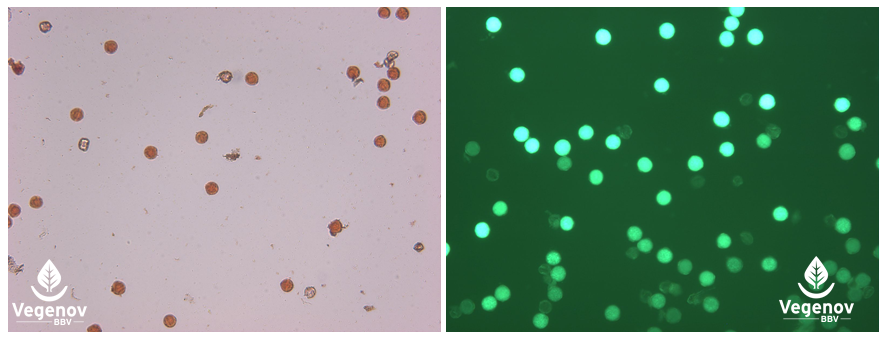
Les colorations au carmin acétique (1) ou au FDA (2) permettent de mesurer la viabilité du pollen, ici d’aubergine. 1. Les cellules au cytoplasme coloré en rouge sont considérées comme viables ; 2. les cellules dont l’intensité de fluorescence verte est forte sont considérées comme viables.
De plus, la microscopie ne permet pas de compter de grandes quantités de cellules. Le travail de comptage est long et fastidieux.
Les tests de germination de pollen in vitro, quant à eux, mettent en œuvre des milieux de culture complexes et variés en fonction des espèces. Ils ne fonctionnent pas toujours très bien. Pour certaines espèces, aucun protocole n’a pu être mis au point (céréales).
Des méthodes d’observation de la germination in situ ont été développées et fonctionnent généralement bien, mais sont très lourdes à mettre en œuvre : quelques heures après la pollinisation, les pièces fertiles des fleurs sont prélevées sur la plante et fixées. Puis les échantillons sont colorés et observés au microscope individuellement (Jahier et al., 1992).
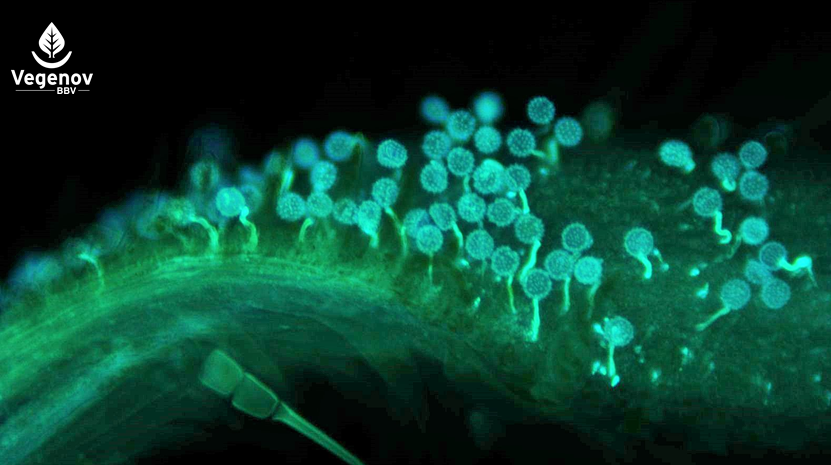
Germination des grains de pollen sur le stigmate observée au microscope à fluorescence après coloration au bleu d’aniline.
Une méthode d’analyse innovante : l’analyse de cellules isolées par impédance en cytométrie de flux
Récemment une méthode permettant de réaliser ces différents types d’analyses en une seule mesure a été mise au point par Amphasys. Elle repose sur l’analyse par impédance en cytométrie de flux de cellules isolées. Lors de l’application d’un courant électrique alternatif, l’impédance de chaque cellule est mesurée dans une puce microfluidique. L’impédance d’une cellule varie en fonction :
- de la fréquence du courant alternatif,
- de la capacité de la membrane,
- du volume de la cellule,
- de la conductivité du cytoplasme.
Cette technique permet d’automatiser le comptage des grains de pollen et de mesurer leur viabilité qui varie en fonction, par exemple, des conditions d’élevage, des génotypes, de l’impact de la température ou des traitements insecticides. Non-destructive, elle ne nécessite pas d’avoir recours à des outils optiques ni de marquer les cellules par fluorescence.
L’automatisation du comptage et de la mesure de viabilité du pollen rend cette phase nettement moins lourde et plusieurs milliers de cellules peuvent être analysées contre quelques centaines par microscopie.
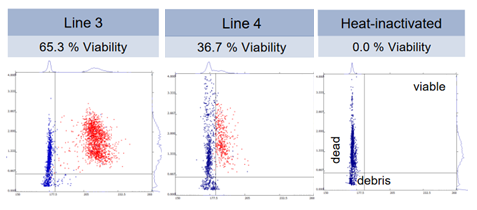
La figure ci-dessus représente un ensemble de mesures individuelles d’impédance réalisées sur des échantillons de pollen de deux variétés de blé. L’impédance de chaque cellule est représentée par deux paramètres reportés sur les axes des abscisses et des ordonnées. Le nuage de points bleu représente les cellules mortes (identique au témoin pollen inactivé) et le nuage rouge les cellules vivantes. Un calcul de % de cellules viables en découle.
La machine, baptisée AmphaZ32, a l’avantage d’être facile à déplacer et permet d’aller faire des mesures sur le terrain si besoin.
En fonction de l’espèce végétale, et suite à des mises au point préalables il est possible de réaliser des analyses encore plus pointues. Cette technique permet le suivi des stades de développement du pollen (détection du stade d’avortement des variétés stériles), peut mesurer le potentiel de germination du pollen et même différencier les cellules en fonction de leur ploïdie (Heidman et al., 2016). La calibration des mesures se fait toujours par utilisation des outils classiques de microscopie.
Vegenov utilise cette technologie depuis plus d’un an pour réaliser différents types d’analyses pour ses clients obtenteurs, semenciers ou producteurs de semences.
Murielle Philippot, ingénieur R&D spécialiste des haplométhodes dans l’équipe de biologie cellulaire témoigne des avantages de l’utilisation de cette nouvelle technique :
Grâce à l’outil Amphasys, nous avons pu rapidement mettre au point et étudier le développement du pollen chez de nombreuses espèces végétales.
En mesurant l’impédance, nous pouvons suivre les différents stades de développement et la viabilité de populations importantes de cellules, de manière rapide et très reproductible.
Auparavant nous faisions ces analyses par comptage suite à coloration et observations microscopiques.L’acquisition de cette technologie nous a permis de multiplier les analyses, ce qui augmente la fiabilité de nos résultats.
Nous avons également commencé la mise au point de l’analyse des populations de microspores en culture, pour caractériser et suivre de manière fine leur développement durant l’androgenèse.
Dans un prochain billet, nous vous présenterons plus précisément une étude menée sur cellules isolées en culture.
Références :
Heidmann I., Schade-Kampmann G., Lambalk J., Ottiger M., Di Berardino M. (2016) Impedance Flow Cytometry: A Novel Technique in Pollen Analysis. PLOS ONE 11(11): e0165531
Jahier, J. (1992). Techniques de cytogénétique végétale. Editions Quae 183 pages
http://www.amphasys.com/
Cet article a été rédigé conjointement par :
- Manuelle Bodin, Responsable R&D en Biologie Cellulaire
- Juliette Clément, Responsable veille et Recherche Documentaire
- Murielle Philippot, Ingénieur R&D en Biologie Cellulaire


