Crispr-Cas9, l’outil multi-fonctions de la génétique
Depuis 2012, une technologie d’ingénierie génomique fait beaucoup parler d’elle ! Simple à mettre en place et peu onéreuse, CRISPR-Cas9 est un système qui permet de modifier le génome. Stimuler, inhiber ou remplacer un gène par un autre devient avec cette technique un jeu d’enfant. De nombreuses applications ont déjà été testées notamment dans le domaine du végétal. Focus sur cette technique qui fait le buzz !
Découverte de séquences d’ADN palindromiques
L’histoire débute en 1987 au Japon. Atsuo Nakata, chercheur de l’université d’Osaka, découvre dans le génome de bactéries Escherichia coli des séquences d’ADN répétitives entre lesquelles s’intercale une autre séquence d’ADN (1). En 2002, ces séquences seront baptisée CRISPR pour Clustered Regularly Interspaced Palindromic Repeats (2). Ces séquences d’ADN répétitives sont construites tel un palindrome (mot ou phrase qui peut se lire dans les deux sens, par exemples : radar ou « La malade pédala mal »).
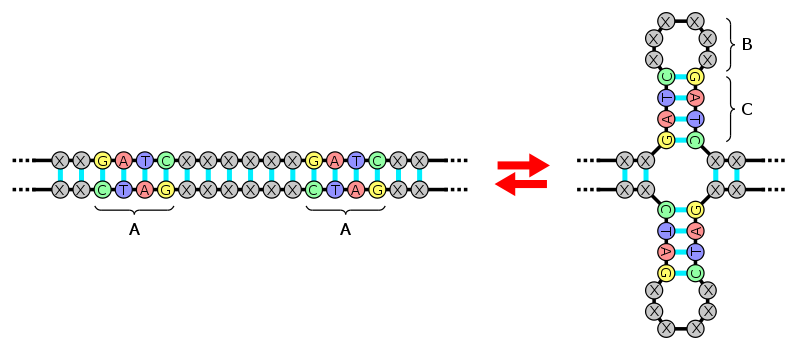
Séquence d’ADN palindromique
Retrouvées chez de nombreux micro-organismes et archées, ces séquences intéressent pourtant peu de monde. Elles ne semblent, en effet, pas avoir d’utilité avérée.
CRISPR et sa partenaire Cas9, un rôle dans les défenses
C’est seulement en 2007, soit 20 ans après leur découverte, que le rôle de ces séquences est identifié. Des chercheurs de l’entreprise agroalimentaire danoise Danisco montrent que les bactéries Streptococcus thermophiles utilisées pour fabriquer des yaourts et des fromages survivent mieux aux infections virales lorsqu’elles possèdent des séquences CRISPR (3).
Les séquences CRISPR agissent en effet à la manière d’un vaccin. Après infection par un virus, les bactéries incorporent dans leur génome des séquences d’ADN viraux. Ceux-ci sont ensuite transcrits en ARN qui s’attellent à une enzyme nommée Cas9. Cette protéine est une endonucléase d’ADN guidée par ARN spécialisée dans la coupure de l’ADN. Elle possède deux zones de coupe actives, une pour chaque brin de la double hélice.
Lors d’une nouvelle infection, les ARN issus des séquences CRISPR servent à guider la protéine Cas9 vers le virus afin de découper son ADN en morceaux. Il sera ainsi éliminé.
 Le système CRISPR-Cas9 permet donc de manière simple et efficace de détecter une séquence d’ADN particulière dans le génome, puis de la découper avec précision… Ces caractéristiques ont alors attisé la curiosité des experts en génie génétique.
Le système CRISPR-Cas9 permet donc de manière simple et efficace de détecter une séquence d’ADN particulière dans le génome, puis de la découper avec précision… Ces caractéristiques ont alors attisé la curiosité des experts en génie génétique.
2012, le début de la folie CRISPR-Cas9
En suivant cette idée, les équipes d’Emmanuelle Charpentier (université suédoise d’Umeå) et de Jennifer Doudna (université de Berkeley) ont détourné le système CRISPR-Cas9 pour qu’il s’attaque non plus à l’ADN viral, mais à celui de la cellule, ce qui permettra de modifier son génome (4).
Des sondes d’ARN artificielles spécifiques d’un gène d’intérêt sont introduites dans la cellule avec l’enzyme Cas9. Le système agit alors comme de véritables ciseaux génétiques. La Cas9 est dirigée vers le gène cible auquel elle s’arrime via la sonde ARN et le coupe à l’endroit précis indiqué par la sonde.
Vidéo de l’INSERM expliquant la technique
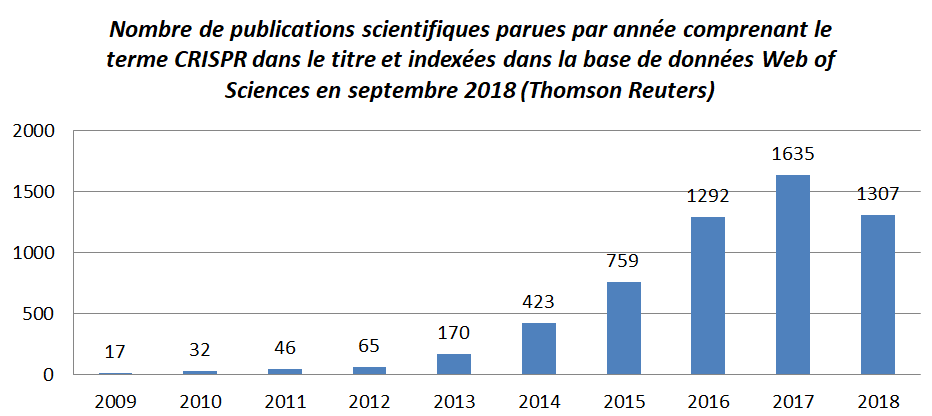
Depuis cette découverte, une explosion de publications dans des revues à comité de lecture atteste de l’intérêt énorme porté à cette technique.
Cet outil est un véritable « couteau suisse génétique » ! En effet, certains chercheurs sont parvenus à modifier légèrement la technique pour que la protéine Cas9 ne coupe pas le gène cible, mais stimule son expression, l’inhibe ou le remplace par un autre.
De nombreuses applications en biologie végétale
De nombreuses études ont déjà été menées sur les applications potentielles de CRISPR-Cas9 à l’agriculture. En voici quelques exemples :
 Chez la tomate, des chercheurs ont utilisé la technique CRISPR-Cas9 pour à la fois stimuler la synthèse de lycopène et inhiber la conversion du lycopène en β- et α-carotène, induisant ainsi une teneur en lycopène 5 fois supérieure dans les fruits produits (5).
Chez la tomate, des chercheurs ont utilisé la technique CRISPR-Cas9 pour à la fois stimuler la synthèse de lycopène et inhiber la conversion du lycopène en β- et α-carotène, induisant ainsi une teneur en lycopène 5 fois supérieure dans les fruits produits (5).
 La gibbérelline est une hormone végétale jouant sur la hauteur des plantes. Le gène GA20-ox qui contrôle sa production dans les plantes peut être modifié grâce à CRISPR-Cas9 comme l’a montré l’équipe du professeur Yi Li de l’Université du Connecticut. Les herbes produisent ainsi une quantité plus faible de gibbérelline, elles poussent moins haut et le gazon aura besoin d’être tondu moins souvent (6).
La gibbérelline est une hormone végétale jouant sur la hauteur des plantes. Le gène GA20-ox qui contrôle sa production dans les plantes peut être modifié grâce à CRISPR-Cas9 comme l’a montré l’équipe du professeur Yi Li de l’Université du Connecticut. Les herbes produisent ainsi une quantité plus faible de gibbérelline, elles poussent moins haut et le gazon aura besoin d’être tondu moins souvent (6).
 CRISPR-Cas9 est utilisée également pour intégrer des résistances à certaines maladies. Ainsi, des chercheurs du Ministère de l’agriculture israélien ont rendu des concombres résistants à des virus destructeurs de récoltes, les potyvirus (7).
CRISPR-Cas9 est utilisée également pour intégrer des résistances à certaines maladies. Ainsi, des chercheurs du Ministère de l’agriculture israélien ont rendu des concombres résistants à des virus destructeurs de récoltes, les potyvirus (7).
 Récemment, le département américain de l’Agriculture a donné son feu vert à la commercialisation d’un champignon de Paris génétiquement modifié par CRISPR-Cas9. Cette modification l’empêche de s’oxyder.
Récemment, le département américain de l’Agriculture a donné son feu vert à la commercialisation d’un champignon de Paris génétiquement modifié par CRISPR-Cas9. Cette modification l’empêche de s’oxyder.
De nombreux autres travaux sont menés sur des espèces très variées comme le montre cet état de l’art paru en 2018 sur l’utilisation de CRISPR pour l’amélioration des cultures (8).
Avantages et limites de la technique CRISPR-Cas9
D’autres techniques d’ingénierie génétique telles que les nucléases à doigts de zinc ou Talen fonctionnent sur un principe similaire à celui de CRISPR. En revanche, leur domaine de reconnaissance n’est pas constitué d’ARN, mais d’un fragment de protéine, nettement plus complexe et long à produire en laboratoire. La technique CRISPR-Cas9 est donc beaucoup plus facile et rapide à mettre en œuvre. Elle est par ailleurs plus précise que les autres techniques de génie génétique et assez peu onéreuse.
Dans certains cas, il est possible que les sondes reconnaissent une partie du génome pour laquelle elles ne sont pas conçues. Il s’agit d’un effet « hors cible » pouvant avoir des conséquences néfastes sur le fonctionnement de la cellule.
Par ailleurs, il n’est pas possible aujourd’hui de prévoir les répercussions de la modification d’un gène sur l’expression ou l’activité d’autres gènes.
CRISPR-Cas9 : organismes GM or not GM ?!
D’un point de vue réglementaire, comment sont considérés les organismes dont l’ADN a été retouché par la technologie CRISPR-Cas9 ? S’agit-il d’OGM (Organismes Génétiquement Modifiés) ou non ?
La question est sensible et la réponse tout autant !
Après des années de batailles et discussions, la Cour de Justice de l’Union Européenne s’est prononcée le 25 juillet 2018 sur le statut des nouvelles techniques de modification génétique du vivant. Son verdict ? Oui, les organismes modifiés par mutagénèse (Pour une définition de ce qu’est la mutagenèse, cliquer ici), sont bel et bien des OGM et doivent obéir à la même règlementation en Europe, y compris ceux produits par les nouvelles technologies de mutagénèse telles que CRISPR-Cas9.
Sources :
(1) Ishino, Y., Shinagawa, H., Makino, K., Amemura, M. et Nakata, A. (1987). Nucleotide sequence of the iap gene, responsible for alkaline phosphatase isozyme conversion in Escherichia coli, and identification of the gene product. Journal of Bacteriology, 169 (12), 5429-5433
(2) Jansen, R., van Embden, J.D.A., Gaastra, W., Schouls, L.M. (2002). Identification of genes that are associated with DNA repeats in prokaryotes. Molecular Microbiology, 43 (6), 1565-1575
(3) R. Barrangou et al., (2007). CRISPR provides acquired resistance against viruses in prokaryotes. Science, 315, 1709–1712
(4) Jinek M., Chylinski K., Fonfara I., Hauer M., Doudna J.A., Charpentier E. (2012). A programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity. Science, 337 (6096), 816-21
(5) Li X., Wang Y., Chen S., Tian H., Fu D., Zhu B., Luo Y., Zhu H. (2018). Lycopene Is Enriched in Tomato Fruit by CRISPR/Cas9-Mediated Multiplex Genome Editing. Frontiers in plant science, 9: 159
(6) Yi L. (2018). These CRISPR-modified crops don’t count as GMOs. https://theconversation.com
(7) Chandrasekaran J., Brumin M., Wolf D., Leibman D., Klap C., Pearlsman M., Sherman A., Arazi T., Gal-On A. (2016). Development of broad virus resistance in non-transgenic cucumber using CRISPR/Cas9 technology. Molecular Plant Pathology, 17 (7), 1140-53
(8) Jaganathan, D., Ramasamy, K., Sellamuthu, G., Jayabalan, S., Venkataraman, G. (2018). CRISPR for Crop Improvement: An Update Review. Frontiers in Plant Science, 9, 985
Ce billet a été rédigé conjointement par Céline Hamon, responsable du laboratoire de biologie moléculaire, Manuelle Bodin, responsable du laboratoire de biologie cellulaire, Murielle Philippot, ingénieur de recherche en biologie cellulaire et Juliette Clément, chargée de veille et recherche documentaire à Vegenov.
Crédits photos : Swiss knife - © Destina - © Fotolia Cucumber with slices isolated on a white background - © yurakp - © Fotolia





