(1) Haplométhodes, dans le secret des labos

Sélectionneurs, vous êtes de plus en plus friands d’ « HD », lorsque la technique vous le permet, mais savez-vous comment se passe l’élaboration de votre précieuse population d’haploïdes doublés ?
Les haploïdes doublés sont des plantes parfaitement homozygotes obtenues en un temps réduit, souvent grâce à l’appui de techniques de culture in vitro.
Chez certaines espèces, colza, orge, maïs, certaines potagères, la technique – ou plutôt les techniques – sont maintenant utilisées en routine. Certes, une variabilité de rendements liée au génotype est souvent constatée, mais dans l’ensemble, le laboratoire est à même de répondre à la demande. Une organisation selon un process de production standard est possible.
En revanche, lors de la mise au point ou l’acquisition de nouvelles techniques, nous, biologistes cellulaires, nous heurtons à des questions pointues, coriaces, mais également passionnantes (pour un biologiste cellulaire), qui touchent au développement embryonnaire chez les plantes.
La source des haploïdes doublés est au cœur de la fleur. Un haploïde doublé, c’est au départ une cellule haploïde. Et les cellules haploïdes, on les trouve chez les plantes dans les pièces fertiles : microspores (= grains de pollen immatures) dans les étamines, et ovules dans les pistils.
Le développement embryonnaire en direct grâce aux microspores
Dans ce cas, on parle d’androgenèse. Les techniques consistent à extraire les anthères ou à isoler les microspores et à les placer en culture in vitro. Au bout d’un à deux mois, des embryons ou des cals embryonnaires se forment et peuvent être repiqués.

Cals embryonnaires d’orge et embryons de colza âgés d’environ 1 mois.
Trois facteurs majeurs jouent sur la réussite de ces techniques :
- le stade de prélèvement des microspores, qui est très précis ;
- le choc inducteur de la réorientation du développement, qui peut avoir lieu avant ou après l’introduction in vitro ;
- la composition du milieu de culture in vitro, souvent spécifique à une espèce.
D’autres facteurs moins évidents en conditionnent aussi la réussite, en particulier les conditions de culture des plantes mères…
On connait assez bien les mécanismes généraux du développement embryonnaire chez la microspore (Soriano et al., 2013), car c’est une structure facile à isoler de la plante mère, et donc à observer. De ce fait, c’est même devenu un moyen commode d’étudier le processus de développement embryonnaire chez les plantes.
Dès les années 90, de nombreux biologistes cellulaires ont étudié et caractérisé chaque étape de ce développement, dont le point de départ est une première division de mitose symétrique, différente de la mitose asymétrique qui conduit au grain de pollen (Leroux et al., 2009).
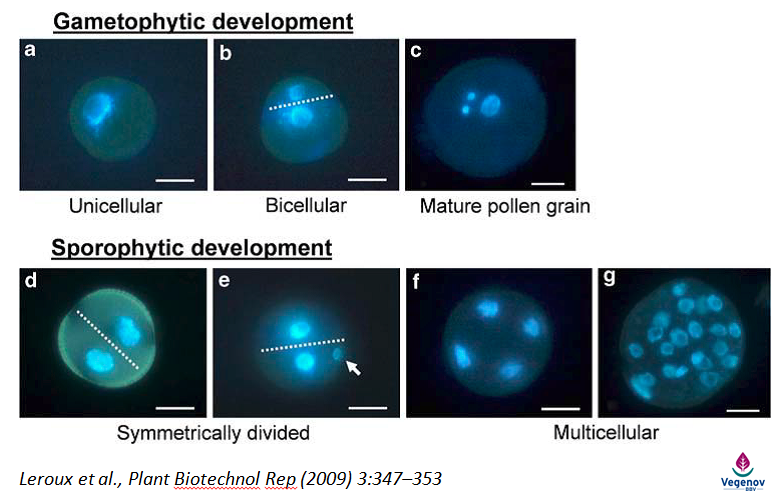
Deux voies de développement de la microspore de colza : gamétophytique, qui aboutit à un grain de pollen et sporophytique, qui conduit à un embryon.
Plus récemment, Daghma et al. (2012) ont mis au point un système qui permet de visualiser en temps réel le développement du proembryon chez l’orge. Ils ont ainsi filmé des cellules durant un cycle de culture, soit 28 jours. Bien entendu, décrire le phénomène ne revient pas à l’expliquer… et les mécanismes d’induction sont parfois difficiles à mettre en évidence.
Des voies d’induction diverses au cœur de l’ovaire
Dans le second cas, c’est le développement d’une cellule du sac embryonnaire (souvent l’oosphère), lui-même au cœur de l’ovaire, qui va donner l’embryon haploïde. C’est la gynogenèse. Là, l’observation est beaucoup plus complexe et, de ce fait, on connait peu de choses sur les mécanismes généraux de ce développement.
Deux approches sont possibles : soit cultiver les pièces fertiles femelles in vitro avant fécondation, comme chez la betterave ou l’oignon (voir article de Bohanec, 2009), soit induire un développement embryonnaire par une pollinisation particulière, souvent suivie d’un sauvetage d’embryon in vitro. Du pollen interspécifique ou intergénérique dont le matériel génétique est éliminé lors des premières divisions du proembryon, ou du pollen dénaturé, non fécondant, sont utilisés en routine chez les céréales ou chez le melon (Dunwell, 2010).

Embryon haploïde d’oignon sortant de l’ovaire de la fleur cultivée in vitro.
Ces techniques sont très efficaces, même si elles sont lourdes à mettre en œuvre, en particulier pour la maîtrise de l’approvisionnement en pollen. Là, ce n’est pas le laboratoire qui va conditionner la réussite, mais les conditions d’élevage des plantes jusqu’aux premières étapes du développement du fruit.
La gynogenèse est souvent utilisée lorsque l’on n’arrive pas maîtriser l’androgenèse, ou lorsque qu’une difficulté majeure se présente, comme on le verra dans mon prochain billet ((2) Haplométhodes : dans le secret des labos)…
Références bibliographiques :
Leroux B., Carmoy N., Giraudet D., Potin P., Larher F., Bodin M. (2009). Inhibition of ethylene biosynthesis enhances embryogenesis of cultured microspores of Brassica napus. Plant Biotechnol Rep 3:347-353.
Bohanec B. (2009). Doubled haploids via gynogenesis. Advances in Haploid Production in Higher Plants ed. Touarev A. Springer Chap. 2 pp 35-46.
Soriano M., Li H., Boutilier K. (2013). Microspore embryogenesis : establishment of embryo identity and pattern in culture. Plant Reprod 26:181-196.
Daghma D.S., Kumlehn J., Hensel G., Rutten T., Melzer M. (2012). Time-lapse imaging of the initiation of pollen embryogenesis in barley (Hordeum vulgare L.). Journal of Experimental Botany 63:6017-6021.
Dunwell J.M. (2010). Haploids in flowering plants : origins and exploitaion. Plant Biotechnology Journal 8:377-424.
Crédits Photos : Image d’illustration du billet : © Expression 2010 ; Toutes les autres photos : © Vegenov-BBV





